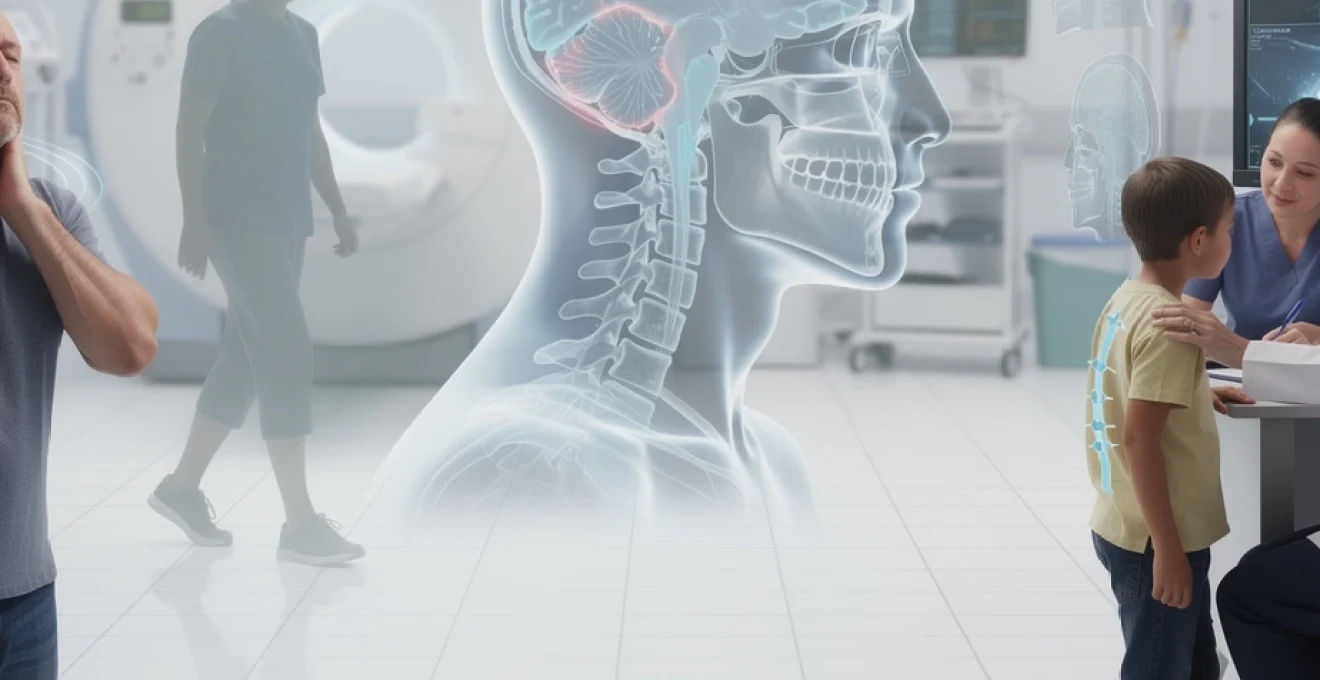
La malformation de Chiari intrigue souvent par la diversité de ses symptômes : maux de tête atypiques, douleurs diffuses, troubles de l’équilibre, fatigue écrasante, parfois même scoliose ou apnées du sommeil. Beaucoup de patients consultent pendant des années avant que l’IRM ne révèle une descente des amygdales cérébelleuses à travers le foramen magnum. Comprendre ce qui se joue à la jonction crânio‑cervicale permet de mieux interpréter ces signes, d’éviter l’errance diagnostique et d’orienter à temps vers une prise en charge spécialisée. Si vous vivez avec des symptômes neurologiques « inexpliqués », ou si une « ectopie amygdalienne » a été évoquée sur un compte‑rendu d’IRM, connaître les bases de la malformation de Chiari aide à poser les bonnes questions à votre neurologue ou à votre neurochirurgien.
Définition de la malformation de chiari : classification (type I, II, III, IV) et anatomie de la jonction cranio‑cervicale
La malformation de Chiari regroupe un ensemble d’anomalies congénitales de la fosse postérieure et de la jonction cranio‑cervicale. Dans toutes ces formes, une partie du cervelet se trouve « aspirée » vers le bas, au travers du foramen magnum, l’ouverture située à la base du crâne par laquelle passent normalement le tronc cérébral et le haut de la moelle épinière. Cette descente modifie l’anatomie locale, comprime les structures nerveuses et perturbe la circulation du liquide céphalo‑rachidien (LCR). La classification actuelle distingue quatre types principaux : I, II, III et IV, de gravité croissante, même si les types III et IV restent aujourd’hui exceptionnels.
Malformation de chiari de type I : descente des tonsilles cérébelleuses et rétrécissement du foramen magnum
La malformation de Chiari de type I est de loin la plus fréquente. Elle se définit radiologiquement par une descente des tonsilles cérébelleuses (ou amygdales cérébelleuses) d’au moins 5 mm sous le plan du foramen magnum. Entre 3 et 5 mm, les radiologues parlent plutôt d’ectopie ou de ptôse amygdalienne et, en dessous de 3 mm, d’une simple variante de la normale. Les études d’IRM populationnelles montrent qu’environ 0,5 à 1 % des adultes présentent une descente significative, mais seulement 0,01 à 0,04 % deviennent réellement symptomatiques, ce qui explique qu’un grand nombre de Chiari soient découverts fortuitement.
Anatomiquement, on observe souvent une fosse postérieure sous‑dimensionnée, comme si la « boîte » osseuse était trop petite pour contenir harmonieusement le cervelet. Le foramen magnum apparaît parfois rétréci, la jonction bulbo‑médullaire est ascensionnée et la dure‑mère peut être épaissie. Pour vous, cela signifie qu’une « petite tête en arrière » peut suffire à engendrer un conflit mécanique durable entre l’os, le cervelet et la moelle cervicale.
Malformations de chiari de type II et spina bifida myéloméningocèle : atteinte complexe du tronc cérébral et du cervelet
La malformation de Chiari de type II survient quasi exclusivement chez les enfants porteurs de spina bifida ouvert (myéloméningocèle). Elle touche environ 1 naissance sur 1 000, mais sa fréquence diminue dans les pays où la supplémentation en acide folique est systématique. Dans ce type, ce ne sont plus seulement les tonsilles qui descendent : le vermis cérébelleux, une partie du tronc cérébral et le quatrième ventricule sont étirés vers le bas, comme une « poche » allongée qui franchit le foramen magnum.
Les symptômes apparaissent tôt, parfois dès la période néonatale, avec des troubles de la respiration, de la déglutition, une hydrocéphalie et des déficits moteurs des membres supérieurs ou des quatre membres. Pour un parent, la découverte de cette association spina bifida–Chiari II implique d’emblée un suivi dans un centre de référence neuro‑pédiatrique, tant le retentissement fonctionnel peut être important tout au long de la croissance.
Formes rares de chiari III et IV : hernie occipitale et hypoplasie cérébelleuse sévère
Les malformations de Chiari de type III et IV sont plus rares et plus sévères. Le type III associe une hernie du cervelet et parfois du tronc cérébral dans un encéphalocèle occipital ou cervical, c’est‑à‑dire une poche méningée contenant du tissu nerveux qui fait saillie à l’arrière du crâne. Le type IV correspond plutôt à une hypoplasie ou agénésie cérébelleuse majeure, sans vraie hernie des amygdales, mais avec un cervelet très sous‑développé.
Ces formes sont en grande partie détectées à l’échographie prénatale et s’accompagnent souvent de malformations associées incompatibles avec une vie autonome. Dans de nombreux pays, elles conduisent à une interruption médicale de grossesse après discussion multidisciplinaire. Pour cette raison, les cliniciens rencontrent aujourd’hui beaucoup moins de Chiari III et IV dans la pratique courante que de Chiari I et II.
Différences entre malformation de chiari, ectopie amygdalienne bénigne et platybasie
La distinction entre vraie malformation de Chiari et simple ectopie amygdalienne bénigne est essentielle pour vous éviter des inquiétudes et des interventions inutiles. Une descente inférieure à 3 mm, sans bloc de circulation du LCR et sans symptôme, est souvent considérée comme une variante anatomique. Entre 3 et 5 mm, le contexte clinique et l’IRM dynamique de flux sont déterminants pour conclure à un Chiari significatif ou non.
La platybasie désigne une déformation de la base du crâne (base plus horizontale, angle basal élargi) qui peut coexister avec un Chiari, mais aussi se rencontrer seule, notamment dans certaines maladies osseuses (rachitisme, ostéogenèse imparfaite, syndromes génétiques). Dans ces situations, l’angle de la base du crâne, l’invagination basilaire et l’alignement des vertèbres C1–C2 sont mesurés précisément afin de différencier une compression médullaire purement osseuse d’une vraie malformation de Chiari.
Une descente amygdalienne visible à l’IRM n’implique pas systématiquement une maladie : la corrélation entre imagerie, symptômes et dynamique du LCR reste le pivot du diagnostic de malformation de Chiari.
Physiopathologie de la malformation de chiari : dynamique du LCR, hydrocéphalie et syringomyélie
Au‑delà de l’anomalie anatomique, la malformation de Chiari est avant tout un trouble de la dynamique du liquide céphalo‑rachidien. Le LCR circule en permanence entre les ventricules cérébraux, les citernes de la base et l’espace sous‑arachnoïdien autour de la moelle épinière, pulsé par l’activité cardiaque et respiratoire. Quand les amygdales cérébelleuses obstruent partiellement le foramen magnum, ce système fermé se comporte un peu comme un réseau hydraulique dont une vanne serait pincée : pressions anormales, turbulences de flux et gradients de pression s’installent entre la tête et le canal rachidien.
Altération de la circulation du liquide céphalo‑rachidien au niveau du foramen magnum
Dans un Chiari de type I symptomatique, l’IRM de flux (séquences phase‑contrast) montre souvent un blocage partiel ou total des échanges de LCR entre la fosse postérieure et le rachis cervical. Les pulsations systoliques se heurtent à la masse amygdalienne, créant des jets de haute vélocité autour des tonsilles et des zones stagnantes en amont. Les études récentes estiment que près de 70 % des patients présentant un Chiari I avec syringomyélie ont un bloc sévère du LCR au niveau du foramen magnum, contre moins de 20 % des Chiari asymptomatiques.
Cliniquement, cette perturbation se traduit par des céphalées d’effort typiques, déclenchées par la toux, le rire ou la défécation. Ces gestes augmentent brutalement la pression veineuse et la pression du LCR dans la tête ; si la « soupape » du foramen magnum ne joue plus, la douleur explose en quelques secondes à l’arrière de la tête et de la nuque.
Formation de syringomyélie cervico‑thoracique : mécanismes de pression et micro‑ischémie médullaire
La syringomyélie, présente dans 14 à 60 % des Chiari de type I selon les séries, correspond à la formation d’une ou plusieurs cavités remplies de LCR au sein de la moelle épinière. L’explication la plus admise repose sur des gradients de pression répétés entre le compartiment intracrânien et le canal rachidien, qui forcent le LCR à pénétrer dans la moelle via de microfissures ou le canal central.
Avec le temps, la cavité syringomyélique s’élargit et s’étend souvent du rachis cervical vers le haut thoracique. Ce « kyste » interne comprime les fibres de la sensibilité thermique et douloureuse et entraîne une souffrance chronique de la microcirculation médullaire (micro‑ischémie). Vous pouvez alors ressentir des brûlures, des paresthésies en « manchon » ou en « cape », ou encore une faiblesse musculaire progressive des mains et des bras.
Hydrocéphalie obstructive associée : compression de l’aqueduc de sylvius et ventriculomégalie
Dans certains cas, la malformation de Chiari s’accompagne d’une hydrocéphalie, surtout dans les types II et les formes pédiatriques sévères. L’obstacle peut se situer au niveau de l’aqueduc de Sylvius, des trous de Luschka ou de Magendie, ou résulter d’un blocage global de la circulation entre les ventricules et les citernes de la base. On parle alors d’hydrocéphalie obstructive, avec dilatation progressive des ventricules latéraux et du troisième ventricule.
Sur le plan clinique, cette hydrocéphalie peut se manifester par des céphalées matinales, des vomissements, une somnolence, voire des troubles visuels (œdème papillaire). Chez le nourrisson, l’augmentation du périmètre crânien et la tension de la fontanelle sont des signes d’alerte majeurs. Une dérivation ventriculo‑péritonéale ou un autre type de shunt de LCR est parfois nécessaire en complément de la décompression de la fosse postérieure.
Facteurs congénitaux et acquis : dysplasie osseuse, craniosténose, instabilité atlanto‑axoïdienne
La plupart des malformations de Chiari sont considérées comme congénitales, liées à un défaut de développement de la fosse postérieure et de la charnière occipito‑cervicale. Toutefois, des formes acquises existent, par exemple après une craniosténose opérée, une dérivation de LCR trop drainante ou la présence d’une tumeur occupant la fosse postérieure. Certaines maladies du tissu conjonctif (syndrome d’Ehlers‑Danlos, maladie de Marfan) et des dysplasies osseuses peuvent aussi favoriser une fosse postérieure exiguë ou une instabilité atlanto‑axoïdienne.
Dans ces contextes, le neurochirurgien analyse toujours finement l’architecture osseuse : bascule de l’odontoïde, invagination basilaire, instabilité C1–C2. Parfois, une fusion occipito‑cervicale ou une stabilisation rachidienne doit être combinée à la décompression du Chiari. Pour vous, cela implique que l’étiologie de la malformation soit bien explorée, car elle conditionne le choix de la stratégie thérapeutique et la surveillance à long terme.
La malformation de Chiari ne se résume pas à une « hernie du cervelet » : elle traduit un déséquilibre complexe entre architecture osseuse, contenu neural et hydrodynamique du liquide céphalo‑rachidien.
Symptômes typiques de la malformation de chiari chez l’adulte : céphalées, troubles sensitifs et atteinte cérébelleuse
Chez l’adulte, la malformation de Chiari de type I peut rester silencieuse toute une vie ou, au contraire, provoquer un tableau neurologique riche mais déroutant. Les symptômes débutent le plus souvent à l’adolescence ou chez le jeune adulte, avec un pic de diagnostic entre 20 et 40 ans. Les femmes sont légèrement plus touchées que les hommes (environ 55–60 % des cas dans les grandes séries). Vous pouvez présenter un à trois symptômes seulement, parfois pris à tort pour des troubles psychosomatiques avant que l’IRM ne clarifie la situation.
Céphalées occipitales d’effort (toux, valsalva, sport) et douleurs cervicales irradiant aux épaules
Les céphalées occipitales d’effort constituent le symptôme emblématique du Chiari de type I. La douleur siège à l’arrière de la tête, de part et d’autre de la nuque, et irradie souvent vers les épaules ou la partie haute du dos. Elle est volontiers déclenchée ou renforcée par les manœuvres de Valsalva : toux, éternuement, fou rire, effort de poussée aux toilettes, port de charges lourdes.
Cette signature clinique est si caractéristique que, face à ce type de mal de tête répété, un neurologue expérimenté pense rapidement à demander une IRM cranio‑cervicale. Si vous reconnaissez ce profil (douleur courte, explosive, liée aux efforts), il est pertinent de le décrire précisément lors de la consultation, avec les circonstances de déclenchement et la durée des crises.
Paresthésies, hypoesthésies et douleurs neuropathiques liées à la syringomyélie
Quand une syringomyélie cervico‑thoracique accompagne la malformation de Chiari, les signes sensitifs deviennent souvent au premier plan. Vous pouvez ressentir des fourmillements, des engourdissements ou des sensations de brûlure dans les mains, les bras, parfois en « cape » sur le haut du tronc. Une perte sélective de la sensibilité à la douleur et à la température, avec conservation du tact, est typique des lésions syringomyéliques.
Ces symptômes neuropathiques, parfois très douloureux, peuvent être confondus avec une neuropathie périphérique, une sclérose en plaques ou une myélite transverse. D’où l’importance d’une IRM médullaire complète et, au besoin, d’un électroneuromyogramme pour préciser le niveau de la lésion et son caractère central.
Ataxie cérébelleuse, dysmétrie et troubles de l’équilibre à la marche
Le cervelet joue un rôle clé dans la coordination, le tonus musculaire et l’équilibre. Quand ses structures sont comprimées par un Chiari, une ataxie cérébelleuse peut apparaître : démarche élargie, instable, difficulté à marcher en ligne droite, sensation d’ivresse sans alcool. Des mouvements maladroits des membres supérieurs, une dysmétrie (tendance à dépasser la cible lors des gestes) ou un tremblement d’intention sont parfois notés à l’examen clinique.
Ces troubles sont souvent subtils au début et peuvent être attribués à de la fatigue ou à un manque d’entraînement physique. Si vous remarquez que vous « accrochez » les coins de meubles plus souvent, ou que vous avez du mal à tenir en équilibre sur un pied, ces petits signaux méritent d’être mentionnés au médecin pour orienter l’examen neurologique.
Symptômes chroniques non spécifiques : fatigue, vertiges, acouphènes, douleurs diffuses
Beaucoup de patients rapportent des symptômes plus diffus : fatigue chronique, vertiges non rotatoires, sensation de tête légère, acouphènes, troubles de la concentration ou du sommeil. Des douleurs musculo‑squelettiques de la nuque, des épaules ou du dos, parfois attribuées à une fibromyalgie, peuvent en réalité être liées à un Chiari ou à une syringomyélie associée.
Ces manifestations non spécifiques expliquent en partie l’errance diagnostique, qui peut atteindre 3 à 8 ans dans certaines enquêtes de patients. Un indice important pour vous et pour le clinicien est l’association de plusieurs symptômes neurologiques (céphalées, troubles sensitifs, déséquilibre, dysphonie, apnées) qui ne s’expliquent pas par une seule maladie fréquente comme la migraine.
Symptômes chez l’enfant et l’adolescent : retard staturo‑pondéral, scoliose et troubles de la déglutition
Chez l’enfant, la présentation clinique de la malformation de Chiari varie selon l’âge et le type. Les formes de type II se révèlent souvent dès la naissance, alors que les Chiari de type I pédiatriques peuvent rester silencieux jusqu’à l’enfance ou l’adolescence. Les pédiatres sont de plus en plus sensibilisés à ce diagnostic face à une scoliose idiopathique atypique, à des troubles respiratoires inexpliqués ou à des céphalées récurrentes résistantes aux traitements usuels.
Signes chez le nourrisson : troubles de la succion, stridor, apnées et retard moteur
Chez le nourrisson porteur d’un Chiari, en particulier de type II, certains signes doivent alerter : difficultés de succion, fausses routes au biberon, stridor (bruit respiratoire aigu), pauses respiratoires, pleurs faibles ou fatigue importante à l’alimentation. Un retard d’acquisition motrice (tenue de tête, position assise) peut également refléter une atteinte du tronc cérébral ou du cervelet.
Dans ces situations, une IRM cérébrale et médullaire complète est généralement indiquée, souvent déjà initiée du fait d’un spina bifida associé. La présence d’une hydrocéphalie, fréquente dans ces formes, impose un suivi rapproché du périmètre crânien et de la vigilance de l’enfant.
Scoliose idiopathique précoce et déformations rachidiennes associées à une syringomyélie
La scoliose est un mode révélateur classique du Chiari de type I avec syringomyélie chez l’enfant et l’adolescent. Dans certaines séries, jusqu’à 30–40 % des enfants opérés d’un Chiari I présentaient une déformation scoliotique significative. La courbure est parfois rapidement progressive, atypique par sa localisation ou sa rigidité, ce qui incite l’orthopédiste à demander une IRM médullaire.
Si votre enfant présente une scoliose idiopathique précoce, surtout avant 10 ans, associée à des douleurs neuropathiques, une maladresse ou des troubles sphinctériens, une exploration neuroradiologique de la charnière cranio‑cervicale et de la moelle est vivement recommandée afin de ne pas passer à côté d’une syringomyélie sous‑jacente.
Troubles de la déglutition, dysphonie, ronflements et apnées du sommeil
L’atteinte des nerfs crâniens inférieurs et du tronc cérébral dans les malformations de Chiari peut provoquer des troubles de la déglutition (dysphagie), une voix enrouée (dysphonie), des ronflements importants et des apnées du sommeil, y compris chez des enfants autrement en bonne santé. Les parents rapportent parfois des réveils en sursaut, une agitation nocturne, voire des pauses respiratoires observées.
Une polysomnographie (enregistrement du sommeil) peut objectiver un syndrome d’apnées centrales du sommeil, directement lié à la compression des centres respiratoires bulbo‑pontiques. Ce type de trouble respiratoire fait partie des critères de gravité et oriente plutôt vers une prise en charge neurochirurgicale rapide.
Retard scolaire, céphalées récurrentes et diagnostic différentiel avec migraine de l’enfant
Chez l’enfant plus grand ou l’adolescent, la malformation de Chiari se manifeste fréquemment par des céphalées récurrentes, parfois confondues avec des migraines. Les douleurs sont souvent occipitales, aggravées par l’effort ou la toux, et peuvent s’accompagner de nausées, de photophobie ou de vertiges. Un retard scolaire relatif peut s’installer, non pas par déficit intellectuel, mais par fatigue chronique, absences répétées et difficultés de concentration liées à la douleur.
Le diagnostic différentiel avec la migraine de l’enfant repose sur quelques éléments : caractère d’effort très marqué, localisation postérieure, association à des signes neurologiques fins (troubles de l’équilibre, vision double, dysarthrie). Si vous êtes parent et que votre enfant présente ce profil, une évaluation en neuropédiatrie avec IRM cranio‑cervicale offre une sécurité diagnostique importante.
Diagnostic de la malformation de chiari : imagerie par IRM et bilans complémentaires
Le diagnostic de malformation de Chiari repose d’abord sur l’imagerie par résonance magnétique, complétée au besoin par des examens fonctionnels. L’enjeu n’est pas seulement de mesurer une descente amygdalienne en millimètres, mais d’apprécier l’impact réel sur la moelle, le tronc cérébral et la circulation du LCR. Selon les symptômes, des examens neurophysiologiques (potentiels évoqués, ENMG) ou une polysomnographie peuvent affiner l’évaluation.
IRM cérébrale et médullaire : mesure de la descente des tonsilles en millimètres et analyse du tronc cérébral
L’IRM est l’examen de référence pour objectiver une malformation de Chiari. Les coupes sagittales médianes permettent de mesurer précisément la distance entre la pointe des tonsilles cérébelleuses et le plan du foramen magnum. Une descente ≥ 5 mm, associée à un bloc de LCR et à des symptômes compatibles, confirme généralement le diagnostic de Chiari I. L’IRM explore aussi la forme et le volume de la fosse postérieure, l’alignement de la charnière et la présence d’une syringomyélie ou d’une hydrocéphalie.
Un bilan complet inclut presque toujours une IRM médullaire entière, du bulbe jusqu’au cône terminal, afin de rechercher une cavité syringomyélique, une moelle attachée ou d’autres pathologies associées. Pour vous, demander explicitement une « IRM cérébrale et médullaire » garantit que le radiologue disposera du champ d’exploration suffisant pour analyser l’ensemble de l’axe neuraxial.
IRM dynamique de flux du LCR (phase‑contrast) : quantification des vitesses et bloc de circulation
Lorsqu’il existe un doute sur le caractère symptomatique d’un Chiari ou sur l’indication opératoire, une IRM dynamique de flux (séquences phase‑contrast) est particulièrement informative. Cette technique mesure les vitesses du LCR au cours du cycle cardiaque et visualise les jets de flux à travers le foramen magnum. Un bloc complet ou une forte asymétrie de circulation en avant et en arrière des tonsilles renforcent la responsabilité du Chiari dans vos symptômes.
À l’inverse, une descente amygdalienne modérée avec flux de LCR conservé et absence de syringomyélie oriente plutôt vers une surveillance clinique et radiologique qu’une chirurgie immédiate. Ce type d’examen, de plus en plus répandu dans les grands centres, illustre les progrès récents de l’imagerie dans l’évaluation fine de la dynamique du LCR.
Scanner et reconstructions 3D de la charnière cranio‑cervicale : évaluation de la fosse postérieure et des anomalies osseuses
Le scanner, en complément de l’IRM, permet une analyse détaillée des structures osseuses de la base du crâne et de la colonne cervicale haute. Des reconstructions 3D aident le neurochirurgien à planifier une craniectomie sous‑occipitale, à estimer la taille optimale de la fenêtre osseuse et à évaluer les risques d’instabilité. Le scanner met en évidence les anomalies telles que platybasie, invagination basilaire, analyse des arcs de C1 et C2 ou fusion congénitale des vertèbres.
Même si vous ne ressentez pas directement la différence entre scanner et IRM, comprendre leur complémentarité aide à accepter la nécessité de plusieurs examens : l’IRM pour le « contenu » nerveux et le LCR, le scanner pour le « contenant » osseux et la stratégie chirurgicale.
Potentiels évoqués, électroneuromyogramme et polysomnographie en cas de troubles respiratoires
Dans certains cas, des explorations neurophysiologiques affinent l’évaluation de la sévérité des lésions. Les potentiels évoqués somesthésiques et moteurs (PESS, PEM) mesurent la conduction des voies sensitives et motrices à travers la moelle et le tronc cérébral. Un ralentissement significatif ou une altération de ces réponses confirme un retentissement fonctionnel de la malformation.
L’électroneuromyogramme (ENMG) aide à distinguer une atteinte centrale (syringomyélie, myélopathie cervico‑arthrosique) d’une neuropathie périphérique. En cas de ronflements, d’apnées observées ou de suspicion de syndrome d’apnées centrales du sommeil, une polysomnographie en laboratoire du sommeil est recommandée. Si vous êtes adressé à ce type de bilan, il ne s’agit pas d’une « formalité », mais d’un élément clé pour estimer le risque respiratoire et la priorité à donner à l’intervention.
Diagnostic différentiel : sclérose en plaques, tumeur de la fosse postérieure, myélite transverse
Les symptômes de la malformation de Chiari peuvent mimer ou coexister avec d’autres pathologies neurologiques. La sclérose en plaques, certaines tumeurs de la fosse postérieure, une myélite transverse, des neuropathies périphériques ou une hypertension intracrânienne idiopathique doivent être systématiquement envisagées. L’IRM, l’analyse du LCR (ponction lombaire) et les bilans sanguins aident à écarter ces diagnostics différentiels.
Il n’est pas rare que des patients reçoivent initialement un diagnostic de migraine, de trouble anxieux ou de fibromyalgie avant que la piste du Chiari ne soit explorée. Dès lors qu’une malformation de Chiari de type I est visualisée, le travail du spécialiste consiste à faire la part des choses entre ce qui lui est imputable et ce qui relève d’une autre affection, afin d’éviter une chirurgie inutile ou incomplète.
Critères de sévérité, suivi clinique et indications de prise en charge spécialisée
Tous les Chiari ne nécessitent pas une opération. Le véritable enjeu est de distinguer les formes asymptomatiques, pouvant être simplement surveillées, des formes évolutives ou compliquées justifiant une prise en charge neurochirurgicale. Plusieurs paramètres sont pris en compte : intensité des symptômes, impact sur la qualité de vie, présence d’une syringomyélie, d’une hydrocéphalie ou de troubles respiratoires, résultats de l’IRM de flux et âge du patient.
Pour organiser votre suivi, les spécialistes s’appuient souvent sur un tempo d’IRM répété : tous les 12 à 24 mois pour une malformation de Chiari de type I peu ou pas symptomatique, plus fréquemment en cas de syringomyélie ou de progression clinique. Sur le plan pratique, quelques conseils concrets peuvent vous aider à mieux vivre avec ce diagnostic :
- noter dans un carnet l’intensité, la fréquence et les déclencheurs de vos céphalées occipitales d’effort pour objectiver leur évolution au fil des mois ;
- adapter les activités physiques : privilégier les sports sans impacts ni efforts de poussée brusques, éviter les sports de contact ou les manœuvres de Valsalva répétées si elles aggravent nettement vos symptômes ;
- signaler rapidement tout nouveau symptôme neurologique (faiblesse, troubles de la déglutition, apnées observées, perte de sensibilité) à votre neurologue ou neurochirurgien afin de réévaluer l’indication opératoire.
En termes de sévérité, l’apparition d’une syringomyélie évolutive, d’un syndrome d’apnées centrales du sommeil, d’un déficit moteur objectif ou d’une hydrocéphalie sont considérés comme des marqueurs forts de gravité. Dans ces cas, la décompression de la fosse postérieure a pour but de restaurer une circulation physiologique du LCR, d’alléger les contraintes mécaniques sur la moelle et de stabiliser les fonctions neurologiques. Les grandes études rapportent une amélioration significative des symptômes dans environ 70 à 80 % des Chiari I opérés, avec une stabilisation ou une régression de la syringomyélie dans la majorité des cas.
Un dialogue approfondi avec l’équipe spécialisée permet d’ajuster la décision à votre situation personnelle : type de travail, projets de grossesse, comorbidités (syndrome d’Ehlers‑Danlos, anomalies osseuses, troubles de la coagulation), tolérance à la douleur et attentes en termes de récupération. La place de la rééducation (kinésithérapie, orthophonie, réentraînement à l’effort) est souvent sous‑estimée alors qu’elle joue un rôle majeur pour récupérer au mieux après une décompression ou, en l’absence de chirurgie, pour limiter les retentissements fonctionnels à long terme.